透析溶液中离子浓度大小的比较
- [08-24 19:17:04] 来源:http://www.85jc.com 高考化学复习方法 阅读:8784次
概要:>,> D. >,>解析 据电荷守恒,在滴定过程中存在c(NH4+)+ c(H+)= c(Cl-)+c(OH-),因此不可能出现阴离子浓度都大于阳离子浓度的情况,其他情况可从往氨水中逐滴加入同浓度的盐酸后溶液中离子浓度大小关系动态分析得出。(1)加入少量的盐酸时,溶液中溶质为NH4Cl和NH3·H2O,且c(NH3·H2O)>c(NH4Cl),NH3www.85jc.com·H2O的电离占绝对优势,NH4Cl的水解受到抑制,溶液的PH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(OH-)>c(Cl-)>c(H+);(2)随着盐酸的不断加入,溶液中溶质仍为NH4Cl和NH3·H2O,溶液中c(Cl-)会逐渐大于c(OH-),溶液的pH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);(3)当盐酸加入一定程度时,溶质仍为NH4Cl和NH3·H2O,溶液呈中性。此时溶
透析溶液中离子浓度大小的比较,标签:化学复习方法,高中化学学习方法,http://www.85jc.com
>
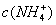
,
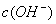
>
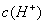
D.
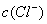
>
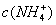
,
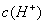
>
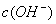
解析 据电荷守恒,在滴定过程中存在
c(NH
4+)+
c(H
+)=
c(Cl
-)+
c(OH
-),因此不可能出现阴离子浓度都大于阳离子浓度的情况,其他情况可从往氨水中逐滴加入同浓度的盐酸后溶液中离子浓度大小关系动态分析得出。
(1)加入少量的盐酸时,溶液中溶质为NH
4Cl和NH
3·H
2O,且
c(NH
3·H
2O)>
c(NH
4Cl),NH
3
www.85jc.com
·H
2O的电离占绝对优势,NH
4Cl的水解受到抑制,溶液的PH>7显碱性,此时溶液中离子浓度关系为:
c(NH
4+)>
c(OH
-)>
c(Cl
-)>
c(H
+);
(2)随着盐酸的不断加入,溶液中溶质仍为NH
4Cl和NH
3·H
2O,溶液中
c(Cl
-)会逐渐大于c(OH
-),溶液的pH>7显碱性,此时溶液中离子浓度关系为:
c(NH
4+)>
c(Cl
-)>
c(OH
-)>
c(H
+);
(3)当盐酸加入一定程度时,溶质仍为NH
4Cl和NH
3·H
2O,溶液呈中性。此时溶液中离子浓度关系为:
c(NH
4+)=
c(Cl
-)>
c(OH
-)=
c(H
+);
(4)加入盐酸的物质的量等于NH
3·H
2O的物质的量时,溶质为NH
4Cl,溶液呈酸性,此时溶液中离子浓度关系为:
c(Cl
-)>
c(NH
4+)>
c(H
+)>
c(OH
-);
(5)如再加入少量的盐酸,溶质为NH
4Cl和HCl,且
c(NH
4Cl)>
c(HCl)溶液呈酸性,此时溶液中离子浓度关系为:
c(Cl
-)>
c(NH
4+)>
c(H
+)>
c(OH
-);
(6)如果再加入大量的盐酸,溶质仍为NH
4Cl和HCl,且
c(HCl)>
c(NH
4Cl)溶液呈酸性,此时溶液中离子浓度关系为:
c(Cl
-)>
c(H
+)>
c(NH
4+)>
c(OH
-)。
因此答案为 C。
上一页 [1] [2] [3] [4]
Tag:高考化学复习方法,化学复习方法,高中化学学习方法,学习方法 - 高中学习方法 - 高三学习方法 - 高考化学复习方法
上一篇:可逆反应达到平衡状态的标志及判断