透析溶液中离子浓度大小的比较
- [08-24 19:17:04] 来源:http://www.85jc.com 高考化学复习方法 阅读:8784次
概要:(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):(1)混合溶液中c(A-)c(HA)(2)混合溶液中c(HA)+c(A-)0.1 mol/L(3)混合溶液中,由水电离出的c(OH-)0.2 mol/LHA溶液中由水电离出的c(H+)(4) 25℃时,如果取0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的PH<7,则HA的电离程度NaA的水解程度。解析 (1)将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,溶质为等物质的量的HA和NaA,已知c(Na+)>c(A-),由电荷守恒可知c(OH-)>c(H+)溶液呈碱性,说明HA是弱酸且电离程度小于A-的水解程度,使得c(A-)<c(HA)。(2)由物料守恒和等体积混合后溶液浓度减半可知:c(HA)+c(A-)=0.1mol/L(3)混合溶液中由于NaA的存在,水解会促进水的电离,而0
透析溶液中离子浓度大小的比较,标签:化学复习方法,高中化学学习方法,http://www.85jc.com
(Na
+)>
c(A
-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中
c(A
-)
c(HA)
(2)混合溶液中
c(HA)+
c(A
-)0.1 mol/L
(3)混合溶液中,由水电离出的
c(OH
-)0.2 mol/LHA溶液中由水电离出的
c(H
+)
(4) 25℃时,如果取0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的PH<7,则HA的电离程度NaA的水解程度。
解析 (1)将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,溶质为等物质的量的HA和NaA,已知
c(Na
+)>
c(A
-),由电荷守恒可知
c(OH
-)>
c(H
+)溶液呈碱性,说明HA是弱酸且电离程度小于A
-的水解程度,使得
c(A
-)<
c(HA)。
(2)由物料守恒和等体积混合后溶液浓度减半可知:
c(HA)+
c(A
-)=0.1mol/L
(3)混合溶液中由于NaA的存在,水解会促进水的电离,而0.2 mol/L HA溶液中水的电离受到抑制,因此前者大。
(4)由(1)分析可知pH<7溶液呈酸性,说明HA电离程度大于A
-的水解程度。
答案(1)< (2)= (3)> (4)>
针对性训练:用0.1 mol?.L
-1的盐酸滴定0.10 mol?.L
-1的氨水,滴定过程中
不可能出现的结果是( )
A.
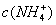
>
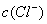
,
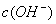
>
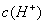
B.
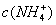
=
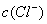
,
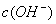
=
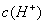
C.
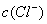
上一页 [1] [2] [3] [4] 下一页
Tag:高考化学复习方法,化学复习方法,高中化学学习方法,学习方法 - 高中学习方法 - 高三学习方法 - 高考化学复习方法
上一篇:可逆反应达到平衡状态的标志及判断