透析溶液中离子浓度大小的比较
- [08-24 19:17:04] 来源:http://www.85jc.com 高考化学复习方法 阅读:8784次
概要:3-);(2)物料守恒:即原子个数守恒,存在于溶液中的某物质,不管在溶液中发生了什么变化,同种元素各种存在形式的和之比符合物质组成比。1.0 mol/L Na2CO3溶液中n(Na)=2n(C) =2.0 mol/L,由于CO32-能水解,故碳元素以CO32-、HCO3-、H2CO3三种形式存在,所以有c(Na+)=2(c(CO32-)+c(HCO3-)+c(H2CO3))。(3)质子守恒:在任何水溶液中,水电离出的H+和OH-的量总是相等。Na2CO3溶液中,c(OH-)=c(H+) +c(HCO3-) +2c(H2CO3),也可以用代入法求,将物料守恒中的钠离子浓度代入电荷守恒中即可求得。分析溶液中存在有哪些平衡时要注意,弱电解质电离出的离子不需要再考虑水解如氢硫酸中的HS-、S2-,弱酸根离子水解出的离子不需要再考虑电离如Na2CO3溶液中的HCO3-。二、常见题型(一)溶质单一型(弱酸、弱碱溶液、盐溶液等)例3.已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为H2RO4==H++HRO4-;HRO4-H++R
透析溶液中离子浓度大小的比较,标签:化学复习方法,高中化学学习方法,http://www.85jc.com
3
-);(2)物料守恒:即原子个数守恒,存在于溶液中的某物质,不管在溶液中发生了什么变化,同种元素各种存在形式的和之比符合物质组成比。1.0 mol/L Na
2CO
3溶液中
n(Na)=2
n(C) =2.0 mol/L,由于CO
32-能水解,故碳元素以CO
32-、HCO
3-、H
2CO
3三种形式存在,所以有
c(Na
+)=2(
c(CO
32-)+
c(HCO
3-)+
c(H
2CO
3))。(3)质子守恒:在任何水溶液中,水电离出的H
+和OH
-的量总是相等。Na
2CO
3溶液中,
c(OH
-)=
c(H
+) +
c(HCO
3-) +2
c(H
2CO
3),也可以用代入法求,将物料守恒中的钠离子浓度代入电荷守恒中即可求得。
分析溶液中存在有哪些平衡时要注意,弱电解质电离出的离子不需要再考虑水解如氢硫酸中的HS
-、S
2-,弱酸根离子水解出的离子不需要再考虑电离如Na
2CO
3溶液中的HCO
3-。
二、常见题型
(一)溶质单一型(弱酸、弱碱溶液、盐溶液等)
例3.已知某二元酸(化学式用H
2RO
4表示)在水中的电离方程式为
H
2RO
4==H
++HRO
4-;HRO
4-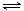
H
++RO
42-回答下列问题:
(1)NaHRO
4溶液显(填“酸性”,“中性”,或“碱性”)。理由是:
(2)在0.1 mol·L
-1的Na
2RO
4溶液中,下列微粒浓度关系式正确的是:。
A.
c(RO
42-) +
c(HRO
4-)+
c(H
2RO
4) =0.1mol·L
-1 B.
c(OH
-)=
c(H
+) +
c(HRO
4-)
C.
c(Na
+)+
c(H
+) =
c(OH
-)+
c(HRO
4--)+2
c(RO
42-) D.
c(Na
+)= 2
c(RO
42-) +2
c(HRO
4-)
(3)如果25℃时,0.1 mol·L
-1NaHRO
4溶液的中,
c(RO
42-)=0.029 mol·L
-1 则0.1 mol·L
-1 H
2RO
4中
c(RO
42-)0.029 mol·L
-1(填“<”,“>”,或“=”)。
(4)如果25℃时,0.1 mol·L
-1H
2RO
4溶液的中,pH=-lg0.11,则此时溶液中
c-1。(RO
42-)=mol·L
解析 (1)H
2RO
4完全电离(“==”)为强酸,故HRO
4-不会水解但会部分电离产生H
+显酸性。
(2)A项中无H
2RO
4,B项是质子守恒,C项是电荷守恒,D项是物料守恒。
(3) 0.1 mol·L
-1 H
2RO
4中,由于H
2RO
4==H
++HRO
4-产生的H
+抑制了二级电离。
(4)由pH=-lg0.11,
c0.1 mol·L-1H2RO4溶液的中第一步电离产生H+的浓度为0.1 mol·L-1,故第二步电离产生H+浓度为0.01mol·L-1,所以c-1。(RO42-)=0.01 mol·L(H+)=0.11 mol/L,而
答案(1) 酸性 HRO
4-不会水解但会部分电离产生H
+ (2)BCD (3)< (4)0.01
(二)溶液混合型
解题思路:先确定混合后溶液的成分(酸碱性),再据电离与水解相对大小程度分析。
例4.将0.2 mol/L HA溶液与0.1 mol/LNaOH溶液等体积混合,测得混合溶液中
c上一页 [1] [2] [3] [4] 下一页
Tag:高考化学复习方法,化学复习方法,高中化学学习方法,学习方法 - 高中学习方法 - 高三学习方法 - 高考化学复习方法
上一篇:可逆反应达到平衡状态的标志及判断